Um funcionário desconfiado e cuidadoso da Anvisa pode exigir que o laboratório responsável pela produção de um medicamento apresente farta comprovação de sua eficácia e segurança. Para alguns essa atitude pode dar a impressão de protelação. Contudo, ela pode salvar muitas vidas. Acabo de ler um importante livro sobre a história da saúde humana e destaquei um episódio, tristemente verdadeiro, que revela como a pressa em aprovar medicamentos pode, em vez de salvar, ameaçar e até ceifar vidas. O que relato é baseado na leitura da versão original da obra, de Jean-David Zeitoun, em francês (La Grande Extension: Histoire de la Santé Humaine), que brevemente estará circulando em língua portuguesa com o título História da saúde humana.
A indústria farmacêutica, como o próprio nome revela, é uma indústria. Isso significa que, dentro do mundo capitalista, em que ela atua e nós vivemos, elabora seus produtos e procura vendê-los, no mercado. Já se pode falar de uma indústria farmacêutica em meados do século XIX. Contudo, só um século depois é que essa indústria começou a se dedicar à população mais ampla, não apenas aos setores privilegiados da sociedade. Isso vai ocorrer quando produtos considerados “maravilhosos” são desenvolvidos (como a própria penicilina) e funcionam como solução para numerosos casos.
Houve também, nos anos 50 do século XX, um desenvolvimento dos testes. Para verificar sua eficácia, o remédio passou a ser testado não apenas em laboratório. As experiências passaram a envolver animais e, mais tarde, até humanos. E uma nova prática se desenvolve nessa fase, a de exigir não apenas a eficácia de um medicamento, mas também a segurança. Mais testes asseguram mais segurança, mas encarecem os produtos: o custo agregado do remédio subirá, e ele pesará mais no bolso do consumidor. Mas hoje não se admite mais utilizar medicamento que não tenha sido devidamente testado em humanos. Assim caminha a indústria de medicamentos.
O grande desafio é encontrar a dose certa de um remédio para prescrever a alguém e resolver seu problema de saúde, sem que ele produza demasiados efeitos negativos. Claro que a aceitação desses efeitos tem a ver com o mal que aflige o paciente e com a chance que ele tem de melhorar com aquele remédio. Alguns efeitos podem ser previstos e, embora indesejados, tolerados. Outros medicamentos, contudo, podem produzir efeitos secundários de tal monta que seu uso acaba se tornando inviável.
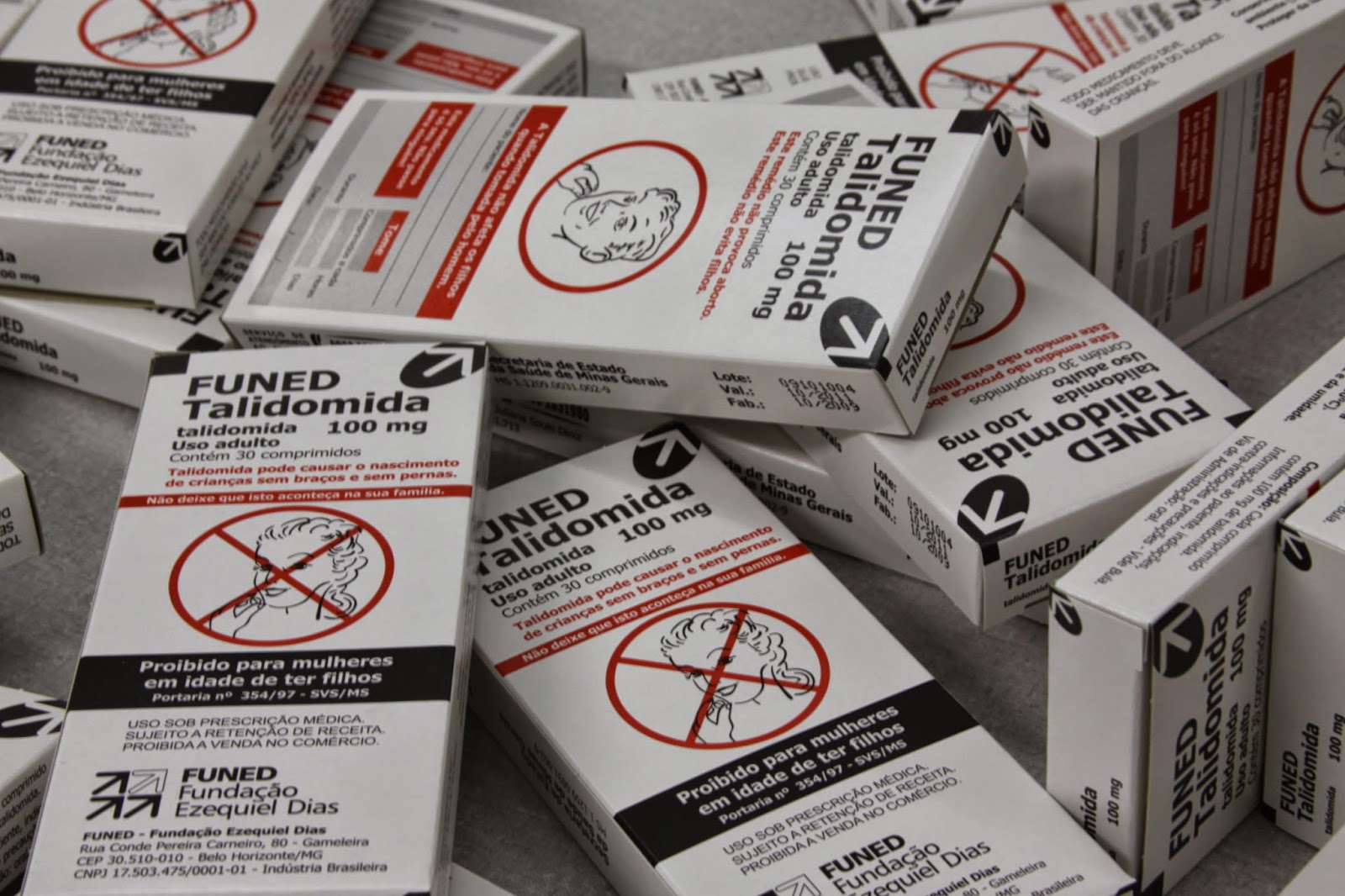
Uma importante mudança ocorreu após a tragédia da Talidomida. Esse caso é mundialmente conhecido: o medicamento foi comercializado na década de 1950 por um laboratório alemão para atenuar as náuseas das mulheres grávidas. Mas a Talidomida era teratogênica, isto é, provocava malformações nos fetos. A anomalia mais característica era a focomelia (o termo designa os membros da foca). É uma atrofia dos membros, com implantação direta das mãos e dos pés no tronco. A criança nascia, praticamente, sem braços e sem pernas. Estima-se que aproximadamente dez mil crianças nasceram com tais malformações devido à Talidomida tomada pela mãe. Um número desconhecido de bebês morreu no útero materno, antes mesmo de nascer. O remédio foi utilizado em muitos países, inclusive no Brasil. Quarenta e dois países foram afetados. Por conta de o laboratório ser na Alemanha, o país foi particularmente atingido. Mas, surpreendentemente, mães americanas nunca tomaram Talidomida.
As americanas foram poupadas simplesmente porque a Talidomida nunca chegou a ser autorizada no país. No momento de examinar o dossiê para aprovação, a farmacologista canadense Frances Kelsey, que acabava de assumir seu cargo na Food and Drug Administration (FDA), achou documento enxuto demais e não ficou convencida com os dados de segurança apesentados pelo laboratório. Pediu mais informações. Sua reserva atrasou o procedimento. No ínterim, estourou o escândalo mundial, o remédio foi proscrito e rejeitado em todos os países. A responsabilidade da Talidomida no surgimento de focomelias fora reconhecida. O medicamento foi retirado do mercado mundial. O fato é que o cuidado de Frances Kelsey salvou da morte, ou de uma vida muito limitada, um número importante de bebês americanos. Ela passou a ser considerada uma heroína nos Estados Unidos e foi condecorada pelo presidente Kennedy em 1962. Quando morreu, em 2015, aos 101 anos, o New York Times escreveu: “A mulher que salvou os bebês americanos”. Embora o país não tenha tido malformações, a violência do choque abriu uma oportunidade política para reformar o mercado farmacêutico, fortalecendo a FDA. E todas as agências responsáveis por liberar medicamentos no mundo inteiro, inclusive no Brasil, onde temos a Anvisa.
Jaime Pinsky é historiador e editor. Completou sua pós-graduação na USP, onde também obteve os títulos de doutor e livre-docente. Foi professor na Unesp, na própria USP e na Unicamp, onde foi efetivado como professor adjunto e professor titular. Participa de congressos, profere palestras e desenvolve cursos. Atuou nos EUA, no México, em Porto Rico, em Cuba, na França, em Israel, e nas principais instituições universitárias brasileiras, do Acre ao Rio Grande do Sul. Criou e dirigiu as revistas de Ciências Sociais, Debate & Crítica e Contexto. Escreve regularmente no Correio Braziliense e, eventualmente, em outros jornais e revistas.

